محققان دانشگاه جورجیا در آمریکا توانستهاند با استفاده از نانوذرات اکسید
آهن و یک میدان مغناطیسی متناوب سلولهای تومور سرطانی سر و گردن در موش
را در کمتر از نیم ساعت از بین ببرند، بدون آنکه به سلولهای سالم آسیبی
برسانند.
محققان
دانشگاه جورجیا در آمریکا توانستهاند با استفاده از نانوذرات اکسید آهن و
یک میدان مغناطیسی متناوب سلولهای تومور سرطانی سر و گردن در موش را در
کمتر از نیم ساعت از بین ببرند، بدون آنکه به سلولهای سالم آسیبی برسانند.
این برای اولین بار است که این نوع از سرطان با استفاده از حرارت تولید
شده در اثر اعمال میدان مغناطیسی متغیر به نانوذرات اکسید آهن درمان
میشود.
کیون ژائو استادیار فیزیک دانشکده هنر و علوم این دانشگاه که نویسنده اول
مقاله مربوط به این تحقیق نیز است، میگوید: «ما نشان دادهایم که کشتن
سلولهای سرطانی با استفاده از غلظت پایینی از نانوذرات امکانپذیر است».
این پژوهشگران دریافتند که با استفاده از این نوع درمان، سلولهای سرطانی
که به طور کامل از بافت پوشاننده سطح بدن (اِپیتلیوم) تشکیل شده بودند،
بهراحتی از بین میروند.
محققان زیادی در سرتاسر دنیا روی استفاده از نانوذرات حرارتی در درمان
سرطان کار میکنند. مطالعات قبلی نشان داده بودند که حرارت ایجاد شده با
استفاده از نانوذرات اکسید آهن و یک میدان مغناطیسی متغیر و قوی میتواند
سلولهای سرطانی را از بین ببرد.
در این کار محققان مقدر بسیار کمی (نیم میلیلیتر) از محلول نانوذرهای را
بهطور مستقیم به محل تومور تزریق کردند. سپس موش را بیهوش کرده و آن را
درون یک لوله پلاستیکی حاوی یک سیمپیچ قرار دارند. این سیمپیچ یک میدان
مغناطیسی متغیر با فرکانس تغییر 100 هزار بار در ثانیه تولید میکند. این
میدان مغناطیسی متغیر فقط نانوذرات غلیظ درون تومور سرطانی را گرم کرده و
بافتهای اطراف بدون آسیب باقی ماندند.
بنابر گفته ژائو این کار راه را برای استفاده از نانوذرات زیستتخریبپذیر
مشابه نانوذرات اکسید آهن در کاربردهای دیگری همچون رهایش داروهای ضدسرطان
به محل تومور باز میکند.
ژائو میگوید: «زمانی که سلولهای سرطانی این دمای بالا را تجربه میکنند، در برابر داروها آسیبپذیرتر میشوند».
او میافزاید نانوذرات مغناطیسی اکسید آهن همچنین میتوانند در افزایش وضوح
تصویر تومورها در تصویربرداری تشدید مغناطیسی مورد استفاده قرار بگیرند.
بهعبارت دیگر این نانوذرات میتوانند تومورهایی را که در MRI با چشم
غیرمسلح دیده نمیشوند، قابل تشخیص نمایند.
ژائو میگوید: «من علاقه زیادی به این نانوذرات مغناطیسی دارم، زیرا فکر
میکنم در آینده نزدیک میتوان از آنها بهطور همزمان هم بهعنوان عوامل
درمانی و هم بهعنوان عوامل تصویربرداری (theranostics) بهره برد».
جزئیات این تحقیق در مجله Theranostics منتشر شده است.
منبع:/irannano.org


 کپک پنی سیلین
کپک پنی سیلین  کپک پنی سیلین
کپک پنی سیلین 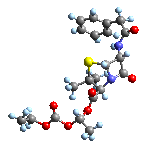 ساختمان پنی سیلین
ساختمان پنی سیلین  پنی سیلین
پنی سیلین