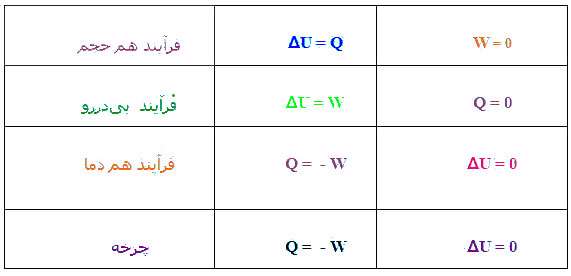
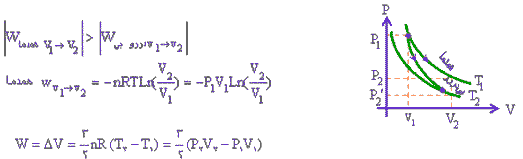الف- گرما
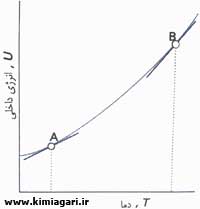
گرما :
شکلی
از انرژی که از جنبش مولکولی ناشی می شود. فرض می شود مولکولهای هر ماده
بطور پیوسته در جنبش اند و شدد گرما ( یا دما ) به سرعت لرزش مولکولی بستگی
مستقیم دارد در صورتیکه آهنگ لرزش جسمی افزایش یابد دمای افزایش و در
صورتیکه آهنگ لرزش کاهش یابد دما نیز کاهش می یابد.
برای
درک کامل این موضوع در نظر داشته باشید که فقط در صفر مطلق 459.8 – درجه
فارنهایت هیچ گونه جنبش مولکولی و بنابراین هیچ گرمایی وجود ندارد و این
بدین معنی است که مولکولهای هر جسم بالای صفر مطلق حرکت ثابتی دارند .
گرم کردن اجسام :
گرم کردن جسم سبب
1- بالا رفتن دما،
2- تغییر حالت ، به طور مثال از جامد به مایع یا مایع به گاز
3- انجام کار بیرونی به وسیله انبساط جسم جامد، مایع یا گاز می شود.
اگر
به یخ گرما داده شود تا به آب تبدیل شود و بنابراین بدون افزایش دما تغییر
حالت دهد تمام این آثار دیده می شود حال چنانچه گرما دادن ادامه یابد تا
آب به نقطه جوش برسد دمای آن افزایش می یابد بدون آنکه تغییر حالت دهد
سرانجام اگر باز هم گرما داده شود آب بخار می شود که تغییر حالتی دیگر است
اما دمای آن افزایش نمی یابد .
با
تولید بخار فشاری نیز به دیواره مخزن که بخار در آن محفوظ است اعمال می
شود اگر این مخزن سیلندری حاوی پیستون متحرک باشد بخار می تواند پیستون را
حرکت داده کار خارجی انجام دهد.
انتقال گرما :
بهتر
است که گرما را مانند سیالی در نظر بگیریم که از جسمی به جسم دیگر جریان
پیدا می کند ولی به بیان دقیق هیچ ماده فیزیکی منتقل نمی شود مولکولهای
ماده گرمتر نسبت به ماده سردتر با آهنگ بالاتری حرکت می کنند بنابراین
زمانی که دو جسم با دمای مختلف با هم تماس پیدا کند جنبش مولکولی در جسم
سردتر افزایش و در جسم گرمتر کاهش می یابد تا تعادل برقرار شود گرما معمولا
از جسم گرمتر به جسم سردتر انتقال می یابد مگر اینکه به کمک عاملی بیرونی (
مثلا در سرد کننده ها ) جهت انتقال گرما به طور مصنوعی برعکس انجام شود.
دما :
معیاری
از شدت گرما یا درجه گرمی یا سردی با مقدار گرما یا سرما تفاوت دارد ممکن
است جسمی کوچک و جسمی بزرگ دقیقا دمای یکسان داشته باشد ولی بدیهی است که
جسم بزرگ مقدار گرمای بسیار بیشتری از جسم کوچک دارد.
ب- اندازه گيری دما
اهمیت اندازه گیری دما :
به
دلیل کنترل کیفیت ، زیرا دمای بخار ( درجه سوپر هیت ) عملیات گرمایی فلزات
، استریل کردن ، پاستوریزه کردن شیر، پالایش نفت ، و کار ایمن ماشین آلات
در هر صنعتی که شامل فرایندهای گرمایش و سرمایش باشد به طور گسترده ای به
اندازه گیری دما بستگی دارد.
یکاهای دما :

در
مقیاس دمای فارنهایت اختلاف دما بین نقطه انجماد و تبخیر آب به 180 قسمت
یا درجه تقسیم می شود رقم 32 درجه فارنهایت را نقطه انجماد و 212 درجه
فارنهایت را نقطه تبخیر در نظر می گیرند .
در
مقیاس دمای سانتیگراد اختلاف دما بین یخ و بخار آب به 100 قسمت یا درجه
تقسیم می شود صفر درجه سانتیگراد نقطه انجماد نسبی و 100 درجه سانتیگراد
نقطه تبخیر آب است .
مقیاس
دمای کلوین مقیاس دمای مطلق است پائین ترین دمای نظری یا صفر مطلق صفر
درجه کلوین وضعیتی است که در آن دما مولکولها از جنبش باز می ایستند و هیچ
گرمایی وجود ندارد.
در
مقیاس فارنهایت این نقطه 459.8 درجه کلوین زیر صفر و در مقیاس سانتیگراد
273 درجه سانیگراد زیر صفر نقطه انجماد آب 273 درجه کلوین یا صفر درجه
سانتیگراد و نقطه جوش آن 373 درجه کلوین یا 100 درجه سانتیگراد است.
منظور از دمای مطلق :
حجم
گاز کامل تحت فشار ثابت به ازای هر درجه سانتیگراد کاهش دما ، به اندازه
273/1 حجم آن در صفر درجه سانتیگراد کاهش می یابد از مطلب معلوم میشود که
در 273 درجه سانتیگراد زیر صفر در مقیاس سانتیگراد حجم گاز به صفر می رسد و
جنبش مولکولی که سبب ایجاد گرما می شود کاملا متوقف می شود این دمای بسیار
پائین صفر مطلق نامیده می شود و پائین ترین دمایی است که می توان به آن
دست یافت.
محاسبات
دمای مطلق از صفر درجه مطلق صورت می گیرد برای تبدیل درجه فارنهایت به
درجه مطلق عدد 460 و در تبدیل درجه سانتیگراد به درجه مطلق عدد 273 اضافه
می شود.
یکاهای اندازه گیری دما :
دما
بر حسب درجه اندازه گیری می شود دماسنجها گستره دماهای معمولی تا 1000
درجه فارنهایت را اندازه گیری می کنند برای اندازه گیری دماهای بسیار بالا و
بیرون از گستره کار دماسنجها از آذرسنج ( پیرومتر ) استفاده می شود.
ساختمان دماسنج:
دماسنج
لوله ای است شیشه ای که سوراخ بسیار باریکی در وسط دارد یک سر آن به شکل
حباب است و سر دیگر بسته شده حباب و قسمتی از لوله با مایع که معمولا جیوه
یا الکل در آن است پر می شود هوای باقی مانده لوله را تخلیه می کنند بجز در
دماسنجهای مورد استفاد ه در دماهای بسیار بالا که فضای باقی مانده با گاز
مخصوصی پر می کنند گستره های تقریبی کار دماسنجهای شیشه ای متداول عبارت
اند از:
جیوه ای از (750 تا 38- ) درجه فارنهایت
جیوه و نیتروژن از ( 1000 تا 38- ) درجه فارنهایت
الکل از ( 150 تا 95- ) درجه فارنهایت
وقتی
جیوه یا الکل در معرض هوا یا مایعی گرمتر از خود قرار گیرند منبسط می شوند
و در لوله بالا می روند انبساطی جزئی سبب حرکت قابل توجه رو به بالا می
شود مقیاس درجه ای که روی شیشه دماسنج جیوه ای چاپ شده دما را نشان می دهد.
1- دما سنج را در فشار مطلق 14.7 psi درون یخ ذوب شده قوطه ور و سر ستون جیوه را نشان گزاری می کنند این نقطه به نام صفر درجه سانتیگراد نقطه انجماد آب می باشد .
2- دماسنج را در آب جوش در فشار مطلق 14.7 psi قوطه ور و سر ستون جیوه را نشان گزاری می کنند این نقطه به نام صد درجه سانتیگراد نقطه جوش آب است .
3- فاصله بین نقاط انجماد و جوش را بر حسب مقیاس سلسیوس یا فارنهایت به ترتیب به 100 قسمت یا 180 قسمت مساوی تقسیم می کنند .
دما
سنج سلسیوس مقیاس منطقی تری نسبت فارنهایت دارد و معمولا در محاسبات علمی
از مقیاس سلسیوس استفاده می شود ولی فارنهایت در بین مهندسان و افراد دیگری
برای مقاصد روزانه به طور وسیع تری مورد استفاده قرار می گیرد .
اندازه گیری دماهای بسیار بالا :
آذرسنجها
می توانند دماهایی بالاتر از گستره کار دماسنجها را اندازه گیری کنند
انواع آنها متعدد است ولی آذرسنجهای الکتریکی از همه متداولترند ترموکوبل و
آذرسنجهای نوری از این جمله اند .
در
ترموکوبل دو میله فلزی غیر هم جنس در یک لوله چینی متصل و درز بندی شده
اند سیمها به این میله ها و به یک گالوانومتر وصل می شوند لوله حاوی میله
ها در نقطه ای قرار می دهیم که هدف اندازه گیری دمای آن می باشند به افزایش
دمای میله ها ولتاژی الکتریکی در محل اتصال القا می شود که
با اختلاف دما بین اتصال گرم و اتصال سرد متناسب است جریان حاصل در مدار
جاری می شود و عقربه گالوانومتر را حرکت می دهد صفحه مدرج گالوانومتر بر
مبنای دما درجه بندی می شود .
آذرسنج
نوری شامل تلسکوپی با یک فیلامان ( رشته ) کوچک است که وقتی جریان
الکتریکی از آن می گذرد گرم و سرخ می شود در مدار فیلامان یک باطری و یک
گالوانومتر قرار دارد که به وسیله مقاومت متغییری که در تلسکوپ نصب شده
جریان گذرا از فیلامان را تغییر می دهیم تا به هنگا م تمرکز یافتن تلسکوپ
روی شعله یا دیواره کوره ، فیلامان کاملا از نظر محو شود. در این نقطه دما
روی صفحه مدرج خوانده می شود .
بر
خلاف ترموکوبل هیچ قسمتی از آذرسنج نوری در معرض گرمای مستقیم کوره نیست و
می توان در فاصله ای مناسب از شعله دما را اندازه گیری کرد کار این وسیله
به این حقیقت بستگی دارد که رنگ و دما با هم رابطه ای یکسان دارند .
آذرسنج نوری الکتریکی دارای یک باطری است ولی ترموکوبل باطری لازم ندارد
.
مقدار گرما :
مقدار گرما با واحد گرمایی بریتانیا ( Btu ) سنجیده می شود . یک Btu
180/1 گرمای لازم برای افزایش دمای یک پوند آب از 32 تا 212 درجه فارنهایت
یا مقدار گرمای لازم برای افزایش دمای یک پوند آب به اندازه یک درجه
فارنهایت است.
ج- گرمای ويژه :
گرمای ویژه :
مقدار گرمای لازم به Btu برای افزایش دمای یک پوند از ماده مورد نظر به اندازه یک درجه فارنهایت است .گرمای ویژه بعضی از مواد متداول
ماده Btu/ib °f) ( گرمای ویژه
آب 1
یخ 0.49
چدن 0.13
مس 0.093
انتقال گرما:
انتقال گرما به سه طریق است
تشعشعی ، هدایت ، جابه جایی

تشعشعی :
در
این روش انتقال گرما از جسم گرم به وسیله امواج اثیری با ماهیتی مشابه
امواج نوری است گرمای تابشی همچنان از هوا می گذرد آن را گرم نمی کند ولی
اجسام جامد که مانع تابش اند آن را جذب یا منحرف می کنند در کوره دیگ و کلیه قسمتهایی که در معرض آتش اند تابش مستقیم گرما داریم .
هدایت :
تماس
مولکولهای یک جسم با یکدیگر سبب عبور گرما از میان جسم می شود برای مثال
اگر یک سر میله ای آهنی در معرض آتش قرار بگیرد در زمان کوتاهی سر دیگر آن
که در دست ماست به سبب هدایت گرما از سر میله که گرم و سرخ شده است ، داغ
می شود و دیگر نمی توان آن را در دست نگه داشت در این حالت گرما از طریق یک
رشته برخورد منتقل می شود مولکولهای گرم و تند رو به مولکولهای سرد و کند
رو برخورد کرده آنها را سرعت می بخشد بدین طریق گرما از دیواره های لوله و
شبکه های دیگر عبور کرده به آب انتقال می یابد.
همانطور
که میدانید اجسام دارای الکترونهای آزاد در خود می باشند که می توانند
حامل انرژی گرمایی و همینطور انرژی ا لکتریکی در خود باشند . که متناسب با
نوع ماده ( ضریب انتقال حرارت هدایتی K ) کم( در اجسام عایق) و زیاد (در اجسام رسانا) می باشد.
جابه جایی:
انتقال گرما به وسیله جریان یافتن را جابه جایی می نامند.
همچنان
که گاز یا مایعاتی که درون ظرفی قرار دارند با گرم شدن انبساط می یابند و
تمایل به بالا رفتن دارند لایه های سردتر گاز یا مایع که در بالا هستند به
علت سنگینی نسبت به گاز یا مایع گرم به سمت پائین جریان می یابند و جای
لایه های گرم شده را می گیرند بدین ترتیب جریانهای همرفتی برقرار می شوند. و
کل گاز یا مایع به تدریج گرم شده دمای آن یک نواخت می شود بدین شیوه است
که رادیاتور بخار ، هوای اتاق را با دمای یکسان گرم نگه می دارد آب درون
دیگ بخار نیز به کمک جریانهای همرفتی ناشی از جریان رو به بالای آب گرم سبک
و در تماس سطح داغ و جریان رو به پائین آب سرد سنگین که در بالا قرار دارد
گرم می شود
.
شدت انتقال حرارت :
رسانندگی گرمایی به آهنگ عبور گرما از میان جسم اشاره می کند این آهنگ برای مواد مختلف فرق می کند و ممکن است به صورت مقدار گرما به Btu
بر ساعت مشخص شود که در قطعه ای به مساحت یک فوت مربع و ضخامت یک اینچ سبب
اختلاف دمای دو سطح مقابل جسم به اندازه یک درجه فارنهایت می شود.
رسانندگی گرمایی با دما چگالی و مقدار رطوبت تغییر می کند به همین دلیل
جدول رسانندگی گرمایی اجسام تنها مقادیر تقریبی را به ما می دهد معمولا
رسانندگی در فلزات با افزایش دما کاهش می یابد ولی در اغلب مواد دیگر
رسانندگی با افزایش دما افزایش می یابد .
ضریب انبساط طولی یک جسم جامد:
ضریب
انبساط طولی نسبت افزایش طول جسم بر اثر انبساط به طول اولیه جسم است وقتی
یک درجه فارنهایت گرما می بیند به بیان دیگر مقدار انبساط واحد طول به
ازای افزایش یک درجه است .
انبساط و انقباض مایعات :
بیشتر
مایعات در زمان گرم شدن منبسط می شوند و در زما ن سرد شدن منجمد،انبساط
مایعات بیشتر از جامدات است و در صورتیکه در محفظه بسته ای محفوظ باشند
فشار زیادی ایجاد می کنند مایعات مختلف میزانهای انبساط مختلفی دارند اتر ،
الکل و نفتهای سبک مثل بنزین میزان انبساط بسیار بیشتری از آب دارند برای
این مایعات انبساط را به صورت حجمی اندازه گیری می کنیم وضریب انبساط حجمی
انبساط هر واحد حجم با افزایش یک درجه فارنهایت است .
اینگونه
نبود رودخانه ها و دریاچه ها در هوای سرد منجمد می شدند و زندگی تمام
گیاهان و حیوانات به خطر می افتاد ترکیدن لوله ها و مخزن های آب به دلیل
نیروی انبساطی آب در حین انجماد است .
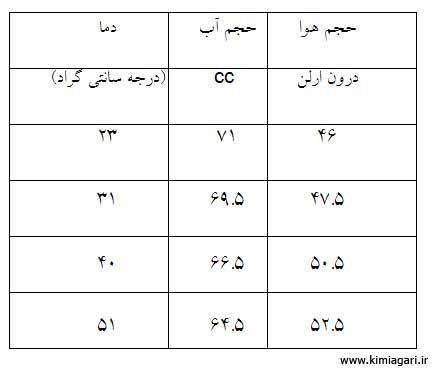
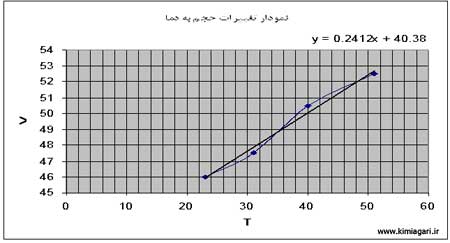
رفتار گازها:
زمانی
که گازها گرما ميبينند حجم يا فشارشان افزايش می يابد و بر عکس در زمان
سرد شدن حجم يا فشارشان کاهش می يابد اين تغييرات از دو قانون ساده چارلز و
گيلوساک پيروی ميکند .
در
زمان استفاده از اين دو قانون در مسائل لازم است که قانون ساده دیگر یعنی
قانون بویل ماریوت را که با تغییرات فشار و حجم سرو کار دارد مطالعه کنیم
زیرا تغییر دما غالبا با تغییر فشار همراه است .
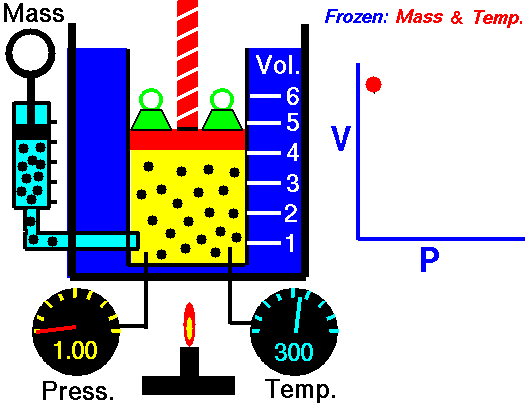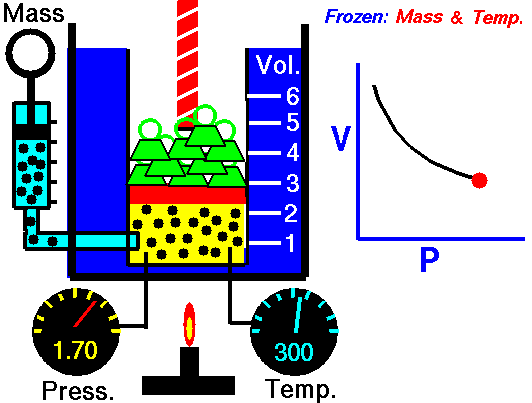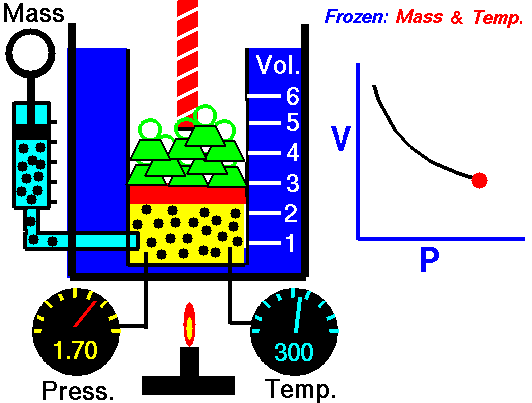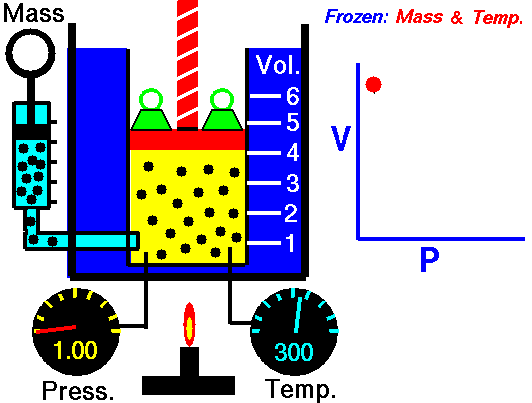
قانون بویل ماریوت:
قانون
بويل ماريوت بيان ميدارد که (چنانچه دمای گازی ثابت باقی بماند ، فشار
مطلق گاز نسبت به نحجم به طور معکوس تغییر خواهد کرد ) مطابق این قانون اگر
به فشار افزوده شود حجم متناسب با آن کاهش پیدا می کند یا برعکس .
مثلا اگر 10 فوت مکعب گاز تحت فشار 10 psi مطلق باشد و فشار به psi مطلق افزایش دهیم حجم به 5 فوت مکعب کاهش پیدا می کند به طور خلاصه در دمای ثابت با دو برابر کردن یکی، عامل دیگر نصف می شود
.
قانون چارلز :
این
قانون بیان می کند که ( چنانچه حجم را ثابت نگه داریم فشار مطلق گاز
مستقیما با دمای مطلق تغییر خواهد کرد توجه کنید که این قانون تناسب مستقیم
است اگر دما 30 درصد بالا رود فشار مطلق نیز 30 درصد افزایش می یابد.
قانون گیلوساک :
قانون فوق بیان می کند که ( چنانچه فشار ثابت باشد ، حجم یک گاز با دمای مطلق به طور مستقیم تغییر خواهد کرد )
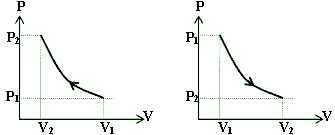
تراکم دما ثابت( ایزوترم ) :
انبساط
یا تراکم گازی در دمای ثابت است یعنی دما حین انبساط یا تراکم ثابت می
ماند این حالت هنگامی پدید می آید که تغییرات بر اساس قانون بویل ماریوت
صورت گیرد .
عملا
هیچگاه انبساط یا تراکم دما ثابت رخ نمی دهد حتی سیلندر کمپرسوری که با آب
سرد می شود ، نمی تواند گرما را به سرعت کافی دفع کند و بنابراین دمای هوا
به هنگام تراکم به سرعت افزایش می یابد .
تراکم آدیاباتیک ( بی دررو ) :
به
وضعیتی می گویند که دما در حین تراکم افزایش و در حین انبساط کاهش می یابد
بدون آنکه گرما از طریق دیواره ها ی سیلندر تلف یا جذب شود شرایط مذکور
هرگز عملا به طور دقیق تحقق نمی یابد اگر چه در بعضی موتورهای گاز سوز یا
کمپرسورهای هوا حالتی نسبتا نزدیک به این وضعیت اتفاق می افتد.
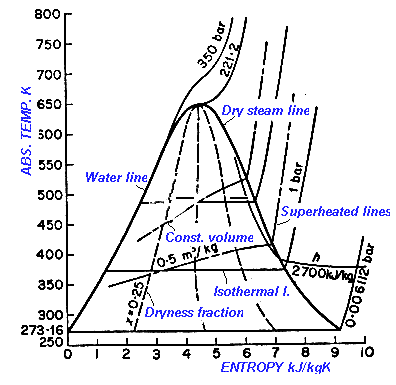
د- اصطلاحات مربوط به بخار آب
بخار آب :
آب
در وضعیت نیمه گاز را بخار آب می گویند اگرچه بخار آب با تغییری در قوانین
ساده گازها رفتاری مانند گازهای ایده آل دارد اما بخار است نه گاز یعنی
ماده ای بین حالتهای مایع خالص و گاز .
چگونگی تولید بخار از آب به درون دیگ بخار :
گرمای کوره از فلز شبکه و لوله ها به آب رسانده می شود و آب مستقیما از فلز گرما می گیرد آب
پس از گرم شدن به سمت بالا می رود و آب سرد به علت سنگینی به سمت پائین
حرکت می کند با جریانهای همرفتی که بدین ترتیب برقرار می شوند همه آبها به
تدریح تا رسیدن به نقطه جوش گرم می شوند حال با ادامه گرما دادن آب به بخار
تغییر فاز می دهد در فرایند فوق هیچ تغییر وزنی وجود ندارد یک پوند آب به
یک پوند بخار تبدیل می شود.
نقطه جوش آب :
نقطه
جوش آب در سطح دریا در فشار یک اتمسفر 212 درجه فارنهایت است با کاهش فشار
نقطه جوش کاهش و با افزایش فشار نقطه جوش افزایش می یابد.
گرمای محسوس :
گرمای
لازم برای افزایش دمای آب از 32 درجه فارنهایت به نقطه جوش است افزایش دما
را می توان با دماسنج اندازه گیری کرد از این رو اصطلاح گرمای محسوس
متداول شده است
.
گرمای نهان تبخیر :
مقدار گرمای لازم برای تبدیل آب در نقطه جوش به بخار با همان دما و
فشار است کلمه نهان به معنی پنهان است و چون در تغییر حالت از مایع به
بخار هیچ نشانی یا اثری از افزایش گرما دیده نمی شود در اینجا بکار برده می
شود.
گرمای کل بخار :
مجموع
گرمای محسوس و نهان آن است . در جدیدترین جدولهای بخار در تعریف فوق به
جای گرما از واژه انتالپی استفاده می شود بنابراین گرمای محسوس انتالپی
مایع گرمای نهان ، انتالپی تبخیر و گرمای کل ، انتالپی بخار می شود .
آب یا بخار در نقطه جوش را اشباع می گویند .
بخار اشباع :
بخار
ی است که از آب تولید می شود و به زحمت می توان آن را بخار نامید هر گونه
اتلاف گرما بدون افت فشار فورا بخار اشباع را تقطیر و به آب تبدیل می کند .
بخار اشباع خشک :
اگر
بخار اشباع ، همان گونه که از آب تولید می شود هیچ گونه رطوبتی به صورت
معلق در آن نداشته باشد ( یعنی قطرات کوچک آب به صورت مایع که در مه یافت
می شود ، در آن نباشد ) بخار را خشک می گویند. حال چنانچه دارای رطوبت باشد
آن را بخار تر می نامند .
بخار
خشک کاملا غیر روئیت است ظاهر سفید و مه مانند بخاری که در هوا تخلیه می
شود ناشی از وجود ذرات آب مایع است که بصورت معلق در بخار وجود دارند .
کیفیت بخار ( عیار ) :
کیفیت
بخار مستقیما به مقدار آب یا رطوبت بخار نشده موجود در بخار اشاره می کند
اگر بخار کاملا خشک باشد کیفیت آن صد در صد ولی اگر دارای 2 در صد رطوبت باشد کیفیت آن 98 در صد خواهد بود .
تعیین عیار بخار :
بوسیله دستگاهی بنام کالری متر صورت می گیرد این دستگاه در سه نوع وجود دارد کالری متر بارل نوع ابتدائی و دقت چندانی ندارد
کالری متر اختناقی تا 7 درصد در فشار 400 psig تعیین می کند .
کالری متر مجزا وسعت اندازه گیری بیشتری دارد و دقیق تر از دو نوع قبل می باشد.
بخار سوپر هیت :
بخار
سوپر هیت بخاری با دمای بالاتر دمای اشباع و در فشار مفروظ است با گذراندن
بخار اشباع از درون لوله مارپیچی که در معرض گرمای گاز کوره است می توان
آن را گرم کرد بخاری که دمایش افزایش یافته یا فوق گرم شده است برای اینکه
تقطیر یابد می بایست به اندازه دمای فوق گرم شدن افت دما پیدا کند.
ای
مسئله در کار نیروگاه فواید قابل ملاحظه ای دارد زیرا اتلاف گرمای تابشی
در لوله های بخار را ممکن می کند در لوله های بخار خطر آسیب دیدن خطوط لوله
و سیلندرهای موتور به وسیله ضربه قوچ آب را کاهش می دهد بازده گرمایی
موتورها و توربین ها را بهبود می بخشد و اثرات مضر رطوبت اضافی در مراحل کم
فشار توربین های بخار را کاهش می دهد .
اثرات افزایش یا افت ناگهانی فشار در مخزن تحت فشار بخار :
افزایش
فشار بدون افزایش متناظر دما سبب تقطیر مقداری بخار خواهد شد زیرا در این
حالت دما افت می کند و از نقطه جوش کمتر می شود حال چنانچه فشار افت کند
دمای بخار بالاتر از نقطه جوش رفته سبب سوپر هیت شدن بخار می شود.
چنانچه افت فشار در یک دیگی صورت گیرد که در آن بخار با آب تماس است به علت پائین آمدن نقطه جوش مقداری از آب به بخار تبدیل می شود .
اگر
افت فشار به طور ناگهانی بوسیله گسسته شدن یا شکستن قسمتهایی از دیگ صورت
گیرد ، ممکن است بخش بزرگی از آب درون دیگ فورا به بخار تبدیل شود که سبب
وقو ق انفجاری خطرناک می شود چون یک پوند بخار در فشار اتمسفر در حدود 1600
برابر فضای اشغال شده به وسیله یک پوند آب را اشغال می کند انرژی انفجاری
آزاده شده توسط چنین فشار ناگهانی بسیار زیاد خواهد بود .
استفاده از بخار در نیروگاه با کاربرد گرمایشی :
با
بررسی جداول بخار در می یابیم که بیشتر گرمای کل مورد نیاز برای تبدیل آب
به بخار برای مایع جوشان به بخار تبدیل می شود نه برای افزایش دما و این
گرمای نهان را بخار پس نمی دهد مگر اینکه تقطیر یابد و به آب تبدیل شود.
در
سیستم گرمایش در رادیاتورها و یا کویل های حرارتی ، بخار چگالش یافته به
آب تبدیل می شود و از این طریق گرمای نهانش را از دست می دهد بنابراین قسمت
بیشتر گرمای بخار در زمان استفاده از بخار برای گرمایش کار مفید انجام می
دهد و در نتیجه سیستم از بازده بالائی برخوردار است.
در نیروگاه که بخار برای تولید برق مصرف می شود خروجی توربین هنوز به شکل بخار است و قسمت بیشتر گرما ی اولیه در بخار می ماند.
دما و فشار بحرانی بخار :
اگر بخاری تحت شرایطی تولید شود که فشار از صد ها psi
تجاوز نکند و بدون افزایش متناظر دما و فشار را تنها بتوان چند پوند
افزایش داد مقداری از بخار تقطیر می شود که به خاطر بالا رفتن دمای جوش است
.اگر فشار به 3206.2psi و متقابلا دما نیز به 705 درجه فارنهایت برسد هیچگونه فشار اضافی سبب کاهش بخار نخواهد شد.
در این نقطه چگالی آب و بخار یکسان است و گرمای نهان تبخیر کاملا ناپدید می شود از این رو اگر از آب تحت فشار 3206.2 psi مطلق تا دمای 705 درجه فارنهایت گرم شود بدون اینکه نیاز به گرمای بیشتری باشد به بخار تبدیل می شود مقادیر 3206.2 psia و دمای 705 درجه فارنهایت ،فشار و دمای بحرانی گوئیم .
موجودیت آن در دمای بالاتر از 705 درجه فارنهایت بصورت مایع غیر ممکن است .
تبخیر معادل :
کلیه
دیگهای تحت شرایط فشار و دمای آب تغذیه یکسان کار نمی کنند بنابراین وزن
واقعی آب در هر ساعت بخار می شود یا هر پوند زغال که می سوزد به روش مناسبی
برای مقایسه دیگهای مختلف نیست مگر اینکه شرایط فشار و دما دقیقا مشابه باشد
اما می توانیم اساس مقایسه ای را برای هر گونه شرایط فشار و دمای آب تغذیه
با مطابق کردن عملکرد دیگ با شرایط استاندارد مهیا کنیم .
مقدار
آب به پوند که با گرما دادن به مدت 1 ساعت و با یک پوند سوخت از آب 212
درجه فارنهایت به بخار 212 درجه فارنهایت با فشار یک اتمسفر تبدیل می شود
یکی از شرایط مورد نظر است این مقدار تبخیر معادل از 212 درجه فارنهایت و
در 212 فارنهایت به ازای هر پوند سوخت است.
مقدار گرمای لازم برای تبخیر یک پوند آب در 212 درجه فارنهایت 970 Btu است .
چنانچه
گرمای کل برای تبخیر در هر ساعت یا بر هر پوند سوخت را بر 970 تقسیم کنیم
تبخیر معادل 212 درجه فارنهایت در هر ساعت یا هر پون به دست می آید.
ظرفیت بندی دیگهای بخار :
گاهی
اوقات ظرفیت اسمی اسب بخار بر اساس فوت مربع سطح گرمایش برای لیسانس یا
مقاصد دیگر پذیرفته می شود اما بخاطر متفاوت بودن طراحی و شرایط عمل دیگهای
با سطح گرمایش یکسان ممکن است از لحاظ ظرفیت بخار دهی فرق کنند که خود
اندازه حقیقی قدرت دیگ است .
یک
روش ظرفیت بندی دیگها بر اساس عملکرد واقعی ، مقدار آبی است که در هر فوت
مربع سطح گرمایش در هر ساعت تبخیر می شود که بطور خلاصه آن ر ا تبخیر معادل
می گویند.
روش دیگر بر اساس گرمای خروجی بخار بر حسب Btu/hr است .
سومین
روش که بر اساس تبخیر است یک اسب بخار دیگ ( خروجی واقعی ) را برابر تبخیر
34.5 پوند آب در ساعت از آب 212 درجه فارنهایت به بخار 212 درجه فارنهایت
با فشار 1 اتمسفر در نظر می گیرد برای پیدا کردن اسب بخار واقعی خروجی در
روش آخر باید تبخیر واقعی را بر حسب پوند آب بر ساعت بیان می شود به تبخیر
معادل تبدیل و سپس آن را بر 34.5 تقسیم می کنند اسب بخار دیگ ارتباطی به
اسب بخار موتور ندارد از روش فوق برای اندازه گیری ظرفیت دیگهای کوچک
استفاده می شود .
بازده یک مولد بخار :
بازده یک مولد صد در صد خواهد بود به شرطی که مولد ارزش گرمایی سوخت را به طور کامل جذب کند .
متاسفانه
وسایل سوزاندن سوخت و کوره نمی توانند از ارزش کامل سوخت بهره برداری کنند
و در نتیجه مولد بخار مرتبط با مانعی در مقابل خود برخورد می کند از لحاظ
نظری بازده مولد بخار نسبت گرمای جذب شد ه به وسیله آب تغذیه به گرمای آزاد
شده در کوره است .چون عملاجداسازی اتلاف کوره از اتلاف مولد بخار مشکل است
نهایتا بازده ظاهری می تواند سودمند باشد و مرسوم است که بازده واحد تولید
بخار را با نسبت گرمای خروجی بخار به گرمای ورودی که سوخت ایجاد می کند
مشخص کند .
دلایل اصلی پائین بودن بازده کوره های دیگ :
پائین
بودن بازده ممکن است به علت طراحی ضعیف دیگ و ساخت بد آن باشد فضای احتراق
ممکن است بسیار کوچک باشد عبور گاز در مسیر کوتاهی صورت گیرد صفحه های
میانی در مکانهای اشتباه تعبییه شده باشد دیوارهای نسوز به گونه ای نامناسب
به پوشش بیرونی چسبیده باشند .
بازده
کم دیگهای موجود از نشت هوای سرد به داخل کوره از لابه لای درزهای آجرهای
کوره و همچنین انتقال بد گرما ار بین توده های دوده و رسوبات روی سطوح
گرمایش دیک ناشی می شود .
گرمای ویژه آب :
مقدار گرمای مورد نیاز به Btu
برای افزایش دمای آب به میزان یک درجه فارنهایت را گرمای ویژه آب می گویند
گرمای ویژه متوسط در فشار اتمسفر 180/1 گرمای مورد نیاز برا ی افزایش دما
به میزان 180 درجه از 32 درجه تا 212 درجه فارنهایت است می توان گرمای ویژه
متوسط را با دقت کافی برابر یک در نظر گرفت .
گرمای ویژه بخار سوپر هیت :
مقدار
گرمای مورد نیاز برای افزایش دمای یک پوند بخار گرم در فشار ثابت به میزان
یک درجه فارنهایت را گرمای ویژه بخار سوپر هیت شده می گویند این کمیت با
فشار و دما تغییر می کند یعنی تابعی از فشار و دما است و گرمای ویژه متوسط
برای یک فیلامان از شرایط مشخص با تقسیم کردن افزایش گرما بر حسب Btu که از جداول بخار فوق گرم پیدا می شود ، بر افزایش دما بر حسب فارنهایت بدست می آید.

![]()